
Para entender el proceso evolutivo que produjo las diferencias entre las proteínas que actúan en el interior de las células y aquellas que se alojan en la membrana o se secretan al exterior (como los anticuerpos, las hormonas y muchas enzimas), científicos argentinos dieron marcha atrás en el tiempo y recrearon una molécula tal como habría existido hace cientos de millones de años.
El estudio iluminó el proceso "increíblemente estricto" de selección evolutiva que permitió separar a lo largo de millones de años unas proteínas de otras, precisó el doctor Julio Caramelo, investigador del CONICET y jefe del laboratorio de Biología Estructural y Celular en la Fundación Instituto Leloir (FIL). Y revela también mecanismos que podrían participar en la génesis de distintas enfermedades congénitas.

Según explica Caramelo, una característica bastante particular de las proteínas "de exportación" o de la vía secretoria es que generalmente tienen una a varias moléculas de azúcar unidas a su estructura, por lo que se las llama glicoproteínas. "Sin esos azúcares, estas proteínas no pueden cumplir en forma eficiente con su función biológica", detalló.
¿Pero cómo evolucionó esa característica?
En una primera etapa del estudio, el doctor Caramelo y su grupo realizaron un análisis computacional para clasificar miles de estructuras conocidas y comparar la estructura de ambos grupos de proteínas.
"Para nuestra sorpresa, descubrimos que en la superficie de las proteínas de la vía secretoria hay un incremento de los sitios de unión para azúcares. Y, lo que es muy notable, esos sitios fueron prácticamente borrados de su región interior. Ese proceso dual no se verificó en aquellas proteínas que quedan confinadas en el interior de la célula", puntualizó Caramelo quien también es profesor de la Facultad de Ciencias Exactas y Naturales de la UBA.
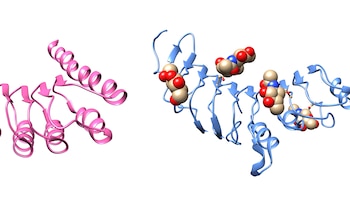
Pero la siguiente fase del experimento fue aún más impactante: Caramelo y su equipo "retrocedieron" en el tiempo cientos de millones de años y recrearon la estructura antigua de una proteína de la vía secretoria. En particular, le repusieron los sitios de unión de azúcares que fue perdiendo a lo largo de la evolución.
El resultado fue sorprendente. "Encontramos que estas proteínas 'revividas' son incapaces de funcionar dentro de la vía secretoria, mientras que sus primas hermanas, aquellas que residen en el interior celular y no son modificadas por azúcares, lo hacen sin problemas", señaló Caramelo.
En síntesis: la desaparición de los azúcares anclados al corazón o interior de las proteínas ha resultado ser un factor crítico para que puedan salir de las células.

Considerando que, dentro de las enfermedades de origen genético, una categoría bastante frecuente son las que implican la aparición anómala de sitios de unión de azúcares, el grupo de Caramelo ahora está abocado a comprender qué factores regulan o modulan ese proceso. "Desde el punto de vista aplicado, estos conocimientos permitirán el desarrollo de técnicas más eficientes para producir glicoproteínas de interés terapéutico para enfermedades tales como infecciones virales, cáncer y patologías autoinmunes", enumeró.
Del avance también participaron Máximo Lopez Medus, María Labanda, Paula Couto, Carlos Labriola, Rodrigo Corti Bielsa y Lucía Zacchi, investigadores del CONICET en el grupo de Caramelo; Gabriela Gómez, del CONICET y de la UBA; Eugenia Clérico, de la Universidad de Massachusetts, en Estado Unidos; y Benjamin Schulz, de la Universidad de Queensland, en Australia.
Con información de la Fundación Instituto Leloir
LEA MÁS:
La Fundación Instituto Leloir cumple 70 años haciendo historia en la ciencia
La rara enfermedad congénita que es comprendida gracias al Nobel argentino Luis Leloir
Avance científico: inyectan ADN editado en un paciente para curarle una enfermedad mortal
Últimas Noticias
Tris: jugada ganadora y resultado de los últimos sorteo del 23 de noviembre

Clima en Zaragoza: el estado del tiempo para este 24 de noviembre

Flow Fest 2024: Sebastián Yatra sube al escenario del Autódromo Hermanos Rodríguez

El estrecho sendero de la reforma de Aerolíneas

Inserción internacional de la Argentina: perspectivas mundiales de comercio e inversiones



