
A partir de la resolución 783/2020 del Ministerio de Salud publicada hoy en el Boletín Oficial, se anunció la creación de un registro de potenciales donantes de plasma, de una lista de ensayos clínicos y la puesta en marcha del programa en seis centros de gestión estatal y dos de gestión privada del Área Metropolitana de Buenos Aires (AMBA).
En el anexo, que lleva la firma de Arnaldo Medina, secretario de Calidad en Salud de la cartera nacional, se explican los tres ejes de investigación del denominado Plan Estratégico para regular el uso de plasma de pacientes recuperados de coronavirus COVID-19 con fines terapéuticos.
El primer eje del documento es el proyecto de desarrollo de una inmunoglobulina hiperinmune a partir del plasma de convalecientes por el nuevo coronavirus.
“Esto se tiene que hacer de forma industrial y lo va a coordinar el Laboratorio de Hemoderivados de la Universidad Nacional de Córdoba, único en Latinoamérica, una fortaleza que tenemos como país”, sostuvieron fuentes sanitarias de la Nación. “Este es un proyecto a mediano plazo, que requiere contar con más de mil pacientes”, agregaron.

Otro eje es el proyecto de desarrollo de un sistema in vitro para la determinación de anticuerpos neutralizantes anti-SARS CoV-2 en convalecientes de COVID-19, coordinado por la Administración Nacional de Laboratorios e Institutos de Salud (ANLIS-INEI –Malbrán, INEVH-Maiztegui).
Asimismo, se menciona el proyecto de desarrollo de un Ensayo Clínico Nacional para evaluar la seguridad y eficacia del uso de plasma de convalecientes en enfermos de coronavirus, con la coordinación la Dirección de Sangre y Hemoderivados.
“En tratamientos por transfusión, que requieren entre 30 y 50 pacientes en cada uno de estos estudios, hay protocolos privados presentados, pero en este Ensayo Clínico Nacional marca la necesidad del rol regulatorio del Estado para, entre otras cosas, evitar la competencia por los pacientes”, explicaron las autoridades de la cartera de Salud.
Sobre este punto, en el anexo de la resolución se explica que el protocolo, desarrollado entre diversas instituciones en un trabajo colaborativo en las últimas tres semanas, “debe ser considerado como faro o guía para todas las instituciones que estén motivadas para embarcarse en este desafío”.
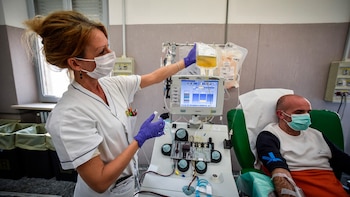
Con ese propósito, se creó “un Registro Único de Ensayos Clínicos que le permita al Ministerio de Salud conocer la totalidad de los ensayos que adopten el Protocolo, tanto en el subsector estatal como privado, para así poder compartir resultados”.
En cuanto a su aplicación, en primera instancia se hará "en la región del AMBA motivo por el cual se le ha solicitado a los coordinadores de Hemoterapia de CABA y Provincia de Buenos Aires que designen las instituciones que iniciarán este proceso".
En esta instancia “se observaron como apropiados seis centros de gestión estatal que incluyen el Hospital del Cruce, Hospital Posadas, Hospital Garrahan y dos centros de gestión privada”, mientras que “en una segunda instancia se deberá convocar a las demás autoridades jurisdiccionales a que designen sus centros oficiales con el fin de sumarse”.

Además, "se contempla la inclusión obligatoria en el Registro Único de Ensayos Clínicos todas las iniciativas que surjan de las Instituciones de gestión privada (como lo ha hecho el CEMIC) a los fines de incrementar los resultados y enriquecer el conocimiento en el tema".
Tanto el CEMIC y el Instituto Italiano son dos de las instituciones privadas que han puesto en marcha ensayos clínicos con plasma.
“Resulta importante iniciar un trabajo colaborativo con la Dirección Nacional de Epidemiología a los fines de contar con el Registro centralizado de pacientes recuperados de COVID-19 potenciales donantes de plasma a fin de poder contactarlos, establecer si cumplen con los criterios de selección y finalmente convocarlos para donar plasma convaleciente en el contexto del ensayo clínico”, indica el documento anexo a la resolución publicada en el Boletín Oficial.

Al considerar que “nos enfrentaremos durante el transcurso del próximo mes de mayo con un incremento significativo de enfermos con un porcentaje de ellos requiriendo cuidados intensivos”, el anexo indica que se podría permitir el “uso compasivo de plasma de convaleciente en esos pacientes de la misma manera que está sucediendo en Europa y en Estados Unidos”.
“Se encuentra en estudio la posibilidad de abrir el ensayo para esos pacientes a través de lo denominado ‘acceso extendido’” abriendo la posibilidad terapéutica a pacientes con enfermedad aguda, o pacientes con riesgo de enfermarse gravemente en hospitales que no participen inicialmente en algún ensayo clínico mencionado, los que serán incluidos en un registro nacional que permita la monitorización concurrente de resultados de eficacia y seguridad", finaliza.
“Todo esto va más allá del Proyecto Solidarity, del que participamos con 10 países. Es un programa de largo alcance y, entre otras cosas, vamos a tener que trabajar en desarrollar puntos seguros de donación”, concluyeron las fuentes.
Con información de Télam
SEGUÍ LEYENDO:
Últimas Noticias
Encuentran un vínculo entre los cambios en la pupila durante el sueño y cómo se procesan los recuerdos

La fruta recomendada para las personas con diabetes que además mejora la salud del hígado

Qué pasa si tomo agua con limón en ayunas todas las mañanas

Cuando las etiquetas y el autodiagnóstico profundizan los padecimientos en salud mental

Cómo estará el clima durante el verano en los principales centros turísticos de la Argentina




