
Desde que en enero se descifró el genoma del SARS-CoV-2 del nuevo coronavirus que genera la enfermedad COVID-19, una carrera de muchos laboratorios de todo mundo comenzó con el fin de obtener una vacuna que detenga las infecciones que generaron la actual pandemia.
Las primeras pruebas en humanos comenzaron hace pocos meses, pero el camino por recorrer sigue siendo incierto. Algunas pruebas fallarán y otras pueden finalizar sin un resultado claro. De acuerdo con la Organización Mundial de la Salud (OMS), actualmente hay en desarrollo más de 175 vacunas en todo el mundo, de las cuales unas 35 ya están siendo probadas en humanos.
En un seminario internacional organizado por la Federación Latinoamericana de la Industria Farmacéutica (Fifarma), los representantes de los laboratorios de 5 de las vacunas más desarrolladas hasta el momento, hablaron en una rueda de prensa donde participó Infobae.
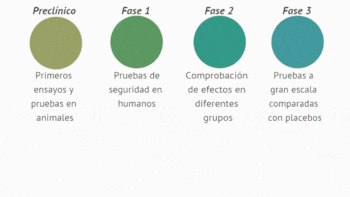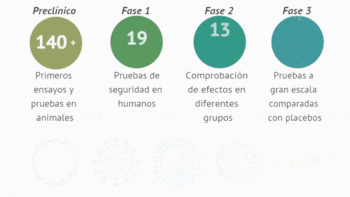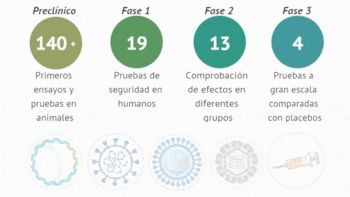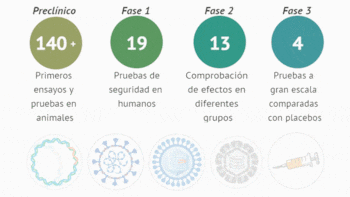
Los expertos hablaron de varios aspectos interesantes respecto a las vacunas que se están desarrollando y experimentando, como el estatus actual, las dosis o refuerzos que tendrán, su futura inmunidad, la producción, distribución y acceso global, entre otras cuestiones clave.
Rafael Andrés Díaz Granados, médico y director ejecutivo de Fifarma dio la bienvenida a los expertos a través de la moderadora, la doctora colombiana Fernanda Hernández.
“Vale la pena señalar dos temas importantes a nivel global respecto a vacunas. Primero, el sistema ‘Access to Covid-19 Tools Accelerator’, también llamado el Acelerador ACT, un sistema anunciado por la quiere la OMS el 24 de abril para acelerar el desarrollo de una vacuna contra el nuevo coronavirus y su disponibilidad de manera equitativa para todos. Y segundo, la creación del Grupo Solidaridad que lleva adelante la OMS en coordinación con más de 100 países” para encontrar mejor tratamiento contra el coronavirus.
Vacuna de Pfizer-Biontech

La vacuna está basada en una tecnología que todavía no ha sido aplicada en humanos: se trata del ARN mensajero, que lleva instrucciones de ADN para que las células del cuerpo humano generen ciertas proteínas protectoras.
La doctora Graciela Morales, jefa de asuntos científicos y médicos para mercados emergentes de la división de vacunas de Pfizer, explicó que la compañía concluyó los estudios de fase 1 y fase2. Y que este lunes comenzó la última etapa de pruebas de su posible vacuna contra el coronavirus.
“Estamos trabajando con una plataforma innovadora, que es de ARN mensajero. Es la primera vacuna de este tipo que llegó a fase 2/3 en el mundo. Al principio, comenzamos a trabajar con 4 vacunas candidatas. Y finalmente se ha seleccionado una de ellas por sus resultados inmunológicos alentadores para ingresar a fase 3 y probarse en 30.000 participantes de varios países, incluida Argentina. Serán vacunadas unas 15.000 personas en una prueba de doble ciego. Lo más importante es que debemos estar atentos a la seguridad, tolerabilidad y respuesta inmunológica”, afirmó.

La especialista precisó que la fase 3 se desarrollará en 120 sitios de prueba diferentes. Entre ellas se cuentan 39 estados de Estados Unidos y otras regiones del mundo con amplia presencia del virus, como Argentina, Brasil y Alemania, con la expectativa de empezar a recolectar resultados alentadores para octubre y tener una vacuna efectiva a fin de año en un esquema de 2 dosis.
“El acelerar el programa clínico también debe ir acompañado del desarrollo de una correcta manofactura. Ello se logra mediante la aceleración de los ciclos de investigación y también de producción. Debemos reorganizar a capacidad de manofactura, porque nos encontramos ante una demanda global. Una sola empresa no va a poder satisfacer a toda la población mundial y la vacuna debe llegar de forma global y simultánea. Así es como vamos a lograr el impacto positivo en la salud pública. Con esa mentalidad, hemos realizado una inversión de riesgo para adelantar la producción a 1.3 billones de dosis hasta fin de 2021. Nos estamos reuniendo con diferentes gobiernos para saber cómo van a ser los programas de distribución de vacunas”, destacó la experta.

Respecto a la seguridad de la vacuna, la doctora explicó que se ha hecho un programa de 4 vacunas con 4 escenarios. “La rigurosidad científica y la seguridad fue siempre la prioridad, el objetivo número 1. El proceso acelerado que implementó su desarrollo no comprometió la seguridad del producto. Tenemos que estudiar en el largo plazo la inmunidad generada por la vacuna. Los estudios en Fase 3 nos acercarán muchas respuestas. Hemos comprobado que dos dosis aplicadas generan anticuerpo más que un paciente convaleciente que ya tuvo COVID-19. Si la vacuna no es accesible, el impacto de la enfermedad va a continuar por mucho tiempo”, detalló.
“Así como la FDA va a priorizar en sus procesos regulatorios el estudio para la aprobación de la vacuna, esperamos que otros gobiernos también lo hagan. Mi mensaje final es que esta pandemia nos trajo grandes desafíos, en el plano familiar, social, económico, y global. También nos trajo oportunidades para hacer mejor las cosas. Este coronavirus llegó en un tiempo en el que se le puede dar una respuesta en un corto tiempo. Hablamos de tener una solución a un desafío de salud pública mundial en menos de un año. Estamos en una carrera contra el virus. Y ya nos ha dejado múltiples señales hacia el futuro ante otras posibles enfermedades”, agregó y concluyó: “Ya vamos 7 meses de pandemia y los niveles de resiliencia y tolerancia van cambiando. Por eso es importante seguir informando y trabajando con optimismo para volver a la nueva normalidad”.
Vacuna de Janssen

Johnson & Johnson ha anunciado que su compañía farmacéutica Janssen ha adelantado el inicio del primer ensayo clínico de fase 1/2a en seres humanos con su vacuna en investigación frente al SARS-CoV-2, la vacuna recombinante Ad26.COV2-S. Inicialmente estaba previsto que el ensayo empezara en septiembre, pero ahora se espera que comience en la segunda quincena de julio.
“Hemos perfeccionado la plataforma de Janssen en la elaboración de la vacuna para COVID-19. Y también comenzamos la producción comercial en forma de riesgo, antes de su aprobación final. Hemos firmado acuerdos con otros laboratorios para producir más de 1000 millones de dosis para 2021”, explicó Josue Bacaltchuk, vicepresidente de medical affairs de Janssen Latinoamérica (J&J).

“Hay que inmunizar al menos al 20% de la población mundial en los próximos meses. Estamos buscando ganarle al virus, nuestro único competidor. La aceleración y la simultaneidad es un riesgo para las industrias que están invirtiendo. No es un riesgo para las personas. Esa información que generamos en los estudios médicos serán elevadas a las autoridades regulatorias de los gobiernos, mientras muchas más pruebas se van a estar evaluando”, destacó el experto.
Y agregó: “Respecto al costo de las vacunas primero se debe determinar la cantidad de dosis, si se va a necesitar refuerzos, etc. Buscamos una vacuna con un solo precio global y que sea accesible al público. Trabajamos con la fundación Gates para tener en cuenta la inversión. Excluye cualquier rentabilidad de la inversión. Auditorías para que el precio sea el más conveniente. Yo creo que la solución más viable es la vacuna, que va a llegar en etapas. Y que va a llegar primero a quienes lo necesiten, al personal de la salud, y los más vulnerables o enfermos. Es importante que todos entiendan eso para lograr avanzar con seguridad. Y esperamos que la humanidad pueda llegar a vivir otra vez con normalidad, quizás mejor que antes”.
Vacuna MSD
La compañía biofarmacéutica MSD ha anunciado tres nuevas iniciativas científicas para combatir el COVID-19. Se trata de dos acuerdos para desarrollar potenciales vacunas contra el SARS-CoV-2 y una colaboración de investigación para avanzar en el desarrollo de un nuevo candidato antiviral.
La doctora Francesca Carvajal, vicepresidenta de operaciones de Investigación Clínica para Latinoamérica de laboratorios MSD, explicó que se trata de un desafío global en el que necesitamos coordinar para doblar el éxito, necesitamos la colaboración de todos los sectores.
Hemos desarrollado una inversión amplia para la elaboración, incrementar su producción y finalmente una correcta y coordinada distribución de vacunas. Estamos trabajando de la mano de gobiernos y autoridades regulatorias para acelerar los tiempos de aprobación y distribución de la vacuna. La observación de los pacientes y el seguimiento que se les hace no se adelanta. Se necesitan al menos 6 meses para probarla”, indicó Carvajal.
Respecto a la accesibilidad de la futura vacuna, Cavajal indicó que todas las vacunas van a ser accesibles y asequibles para todo el mundo. “Somos optimistas por todo el esfuerzo hecho, que vamos a derrotar este virus y la actual pandemia. Como industria e investigadores, nos levantamos para hacer mejor este mundo”, adelantó.
Vacuna de Oxford y AstraZeneca

La vacuna de vector viral desarrollada por la Universidad de Oxford con la firma sueco-británica AstraZeneca se basa en un adenovirus de chimpancé llamado ChAdOx1. Se encuentra en ensayo de Fase II y III en el Reino Unido y de Fase III en Brasil y Sudáfrica.
Tausif Butt, vicepresidente de Astrazeneca en Latinoamérica, indicó que tenemos una plataforma probada y estamos con una capacidad industrial compartida con otras empresas y gobiernos. “Estamos todos trabajando juntos muy bien para lograr una vacuna eficaz y también trabajamos con cadenas de suministros para asegurar que nadie quede atrás en la obtención. Que sea una distribución justa y equitativa”, enfatizó.

“Este es un virus nuevo del cual desconocemos mucho todavía. Necesitamos más tiempo para determinar qué respuesta inmune tendrá la vacuna a futuro. Hay que ser humildes para admitir que no tenemos una respuesta sobre los anticuerpos y cuánto van a durar. Debemos estudiar más las células T por ejemplo respecto a la inmunidad que puede generar”, explicó el experto.
Y concluyó: “Nosotros tenemos un compromiso con la distribución ética de la vacuna. Se trata de un esfuerzo global en el mecanismo Covax. Albert Einstein, dijo que en cada crisis hay una oportunidad. Hoy todo está enfocado en el paciente”.
Vacuna Sanofi Pasteur

El laboratorio Sanofi Pasteur ha comunicado que ha adelantado el inicio de los ensayos clínicos de fase I y II de su vacuna frente al SARS-CoV-2, en colaboración con GSK, para el próximo mes de septiembre. La vacuna utiliza una plataforma similar a la de la vacuna recombinante antigripal Flublok, de manera que insertarán el gen que codifica la glicoproteína S en células de insecto para que expresen el antígeno.
El doctor Ayman Chitt, vicepresidente del área médica de Sanofi Pasteur, precisó que el laboratorio ha estado trabajando en 2 plataformas. Una donde se desactiva el virus y otra en la que se utiliza el ADN para que el cuerpo genere las proteínas para la respuesta inmune.
“Si las cosas van bien, podrá tener una aprobación a fin de mes. El objetivo es que en 2021 se pueda suplir millones de dosis. Es una experiencia que nos da humildad. Toda la raza humana es víctima de este virus. No es que hay una persona, una industria o una nación que tenga la solución. Es necesario compartir todo. La gente tiene esa perspectiva también. Soy optimista de que le ganaremos al virus gracias a los esfuerzos colectivos de las personas”, afirmó Chitt en la rueda de prensa.
En los siete meses que ya lleva la pandemia del coronavirus en el mundo la ciencia y la investigación médica no se ha detenido en busca de una solución efectiva que termine con esta nueva enfermedad.
SEGUÍ LEYENDO:
Últimas Noticias
Día Mundial del Pene: cuidados para la higiene adecuada y consejos para prevenir el cáncer y otras enfermedades

Turbulencias durante el vuelo: cinco consejos para subirse al avión sin miedo

Cuáles son los tres desayunos ideales para personas con diabetes e hipertensión

Cuáles son los 6 alimentos que inflaman y aumentan el riesgo de enfermedades crónicas

Cómo aliviar la ansiedad y reducir el estrés con cinco ejercicios físicos





