
El Instituto Mexicano del Seguro Social (IMSS) realizó una dudosa licitación en la adquisición de pruebas rápidas de detección de COVID-19. Aunque las tres empresas finalistas ofrecieron el mismo producto, una sobresalió por tener “mejores estándares de calidad”.
De acuerdo con la información del periodista Víctor Hugo Arteaga, la dependencia adjudicó un contrato por 325 millones de pesos a la empresa Fármacos DINSA S.A. de C.V. para la adquisición de pruebas rápidas de antígenos SARS-CoV2 (coronavirus).
El argumento fue que el producto arrojaba mejores evaluaciones técnicas que las del resto de proveedores licitantes. Sin embargo, las empresas finalistas ofrecieron el mismo producto comprado al mismo fabricante.

El reportero señala que el pasado 26 de enero la Coordinación de Control de Abasto y de Control Técnico de Insumos del IMSS, a cargo de Carlos Enrique García y Concepción Grajales, emitieron un fallo a la excepción de licitación pública clave 080.110.0041.00.00, para adquirir 325 millones de pesos de pruebas rápidas para detección de COVID-19.
En el fallo se informó que, de las 15 distribuidoras invitadas a participar en la licitación para conseguir el contrato de las pruebas rápidas de COVID-19, sólo tres cumplieron con las especificaciones necesarias: Fármacos DINSA, Roche y Equiver.
Con la idea de ver cuál de las tres empresas “tenía el mejor producto”, aunque ya se sabía que era el mismo fabricado por la empresa coreana SDBiosensor Inc., las pruebas fueron sometidas a una validación de sensibilidad realizada por el Instituto de Diagnóstico de Referencia Epidemiológica (InDRE).
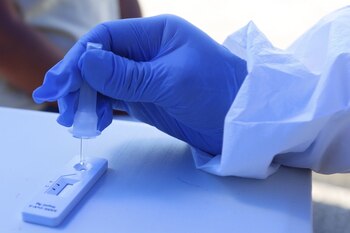
A pesar de que se trataba del mismo producto, con las mismas especificaciones técnicas entregadas por el fabricante, las valoraciones realizadas por el InDRE arrojaron parámetros diferentes. Fueron más altos en el producto de la empresa Fármacos DINSA S.A. de C.V. de Jalisco y cuyo representante legal es Diana Teresa Solís Valdéz.
De acuerdo a los estándares marcados por la Secretaría de Salud de México estipuladas el 11 de noviembre del 2020, los criterios señalan que las pruebas rápidas para detectar COVID-19 deben tener un mínimo de sensibilidad del 80 % y una especificidad del 97% para ser aprobadas.
Los resultados entregados por el InDRE fueron de 93.12% de sensibilidad y 100% de especificidad del producto de DINSA. En cambio, las pruebas de Roche y Equiver tuvieron los mismos parámetros con 88.66% de sensibilidad y con 98.97% de especificidad.

A su vez, Artega resaltó que, a la rareza de que el mismo producto ofrecido por las tres empresas arrojó un resultado diferente, se suma el hecho de que las pruebas ofrecidas por DINSA son más caras que las de Roche y Equiver.
El propio IMSS señaló, en el apartado de Resultados de Investigación de Mercado número 300/20, que Roche presentó a la dependencia una oferta de kits con 25 pruebas del fabricante coreano SDBiosensor Inc. con un costo de 3 mil 125 pesos. No obstante, Fármacos DINSA de Jalisco presentó el mismo producto por un precio de 3 mil 611 pesos.
Vale recordar que la dependencia ha instalado Módulos de Atención para identificar de forma temprana síntomas asociados al coronavirus. De acuerdo con los datos del IMSS, en estos centros, del 24 de diciembre de 2020 al 18 de enero de 2021, se aplicaron 61 mil 676 pruebas para detectar esta enfermedad, de las cuales 28 mil 108 fueron positivas y 33 mil 568 negativas.
MÁS SOBRE ESTE TEMA
Más Noticias
Qué es la meningitis, cuáles son sus síntomas y cómo tratarla

Hermila Galindo: sufragista mexicana, activista feminista y primera candidata a diputada federal

La historia del joven que se salvó de quedar atrapado en El Pinabete, mina colapsada en Coahuila
El desconocido origen estilo “Scarface” del “Mayo” Zambada y el papel de su cuñado cubano, para construir su imperio criminal

Quién es Raquel Buenrostro, próxima titular de la Secretaría de la Función Pública durante el sexenio de Sheinbaum




