
Los casos de viruela del mono, una enfermedad zoonótica viral identificada por primera vez en humanos en 1970, han aumentado considerablemente en el mundo desde mayo último, lo que obligó a la Organización Mundial de la Salud (OMS) a declarar la emergencia sanitaria en julio pasado.
El virus de la viruela del mono (MPXV), que causa enfermedades en los humanos, se ha restringido durante muchos años al continente africano, con solo un puñado de casos esporádicos en otras partes del mundo. Sin embargo, brotes sin precedentes de viruela del mono en regiones no endémicas recientemente han tomado al mundo por sorpresa. En menos de 4 meses, el número de infecciones MPXV detectadas se ha disparado a más de 53.000 casos, registrando un total de 13 muertes.
Pero, ¿qué han aprendido los infectólogos desde el inicio del brote en Reino Unido en mayo último y su expansión a más de 80 países en el mundo?

1-Qué es la viruela del mono
La viruela del simio es una enfermedad viral zoonótica causada por el virus de la viruela del simio (MPXV), un ortopoxvirus que pertenece a la familia de virus Poxviridae. Se identificó por primera vez en 1958 en monos de investigación que se enviaron desde Singapur, lo que probablemente explica por qué la enfermedad se denomina “viruela del mono”. Sin embargo, es más probable que los huéspedes naturales del MPXV sean roedores y otros pequeños mamíferos. El género Orthopoxvirus también incluye el virus de la viruela (VARV), el agente causal de la viruela letal. Los síntomas de la viruela del mono en humanos son relativamente similares a los de la viruela, pero con una tasa de mortalidad más baja.
Los casos esporádicos de MPXV en humanos se identificaron por primera vez en la década de 1970 en varios países africanos, pero el virus se extendió más dentro del continente africano durante los últimos 20 años. Desde mayo de 2022, ha habido un aumento drástico en el número de casos de MPXV en todo el mundo, lo que llevó a la OMS a declarar el brote de viruela símica como una emergencia sanitaria mundial.
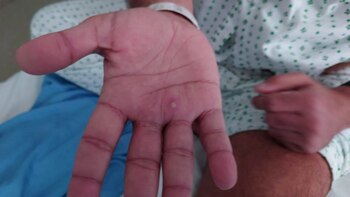
2-Razones del actual brote mundial
Las posibles razones de este brote actual podrían atribuirse a la disminución de la inmunidad contra la viruela en la población general y la terminación del régimen de vacunación contra la viruela humana en 1980. Se ha demostrado que la vacunación contra la viruela ofrece protección contra la viruela del mono. Un estudio inicial de Zaire en 1988 informó que las personas vacunadas contra la viruela (durante una campaña nacional de vacunación contra la viruela que comenzó 12 años antes del inicio de la recopilación de datos) tenían aproximadamente un 85% menos de probabilidades de contraer la viruela del simio que las personas que no estaban vacunadas.
En otro estudio, se encontró que las complicaciones graves y los efectos a largo plazo de la infección por MPXV eran menos frecuentes (39,5% frente a 74%), con tasas de mortalidad más bajas en pacientes vacunados contra la viruela. Recientemente, un estudio sobre 528 infecciones diagnosticadas durante este brote actual informó que solo el 9% de las personas infectadas recibieron vacunas antivariólicas previas. Curiosamente, una característica de los brotes recientes es un número desproporcionado de infecciones en hombres que tienen sexo con hombres (HSH).

3-Riesgo de la enfermedad
Filogenéticamente, MPXV se puede dividir en dos clados distintos: África Central (también conocida comúnmente como Cuenca del Congo) y África Occidental. El clado de África Central generalmente se considera más virulento, con una tasa de mortalidad promedio del 10,6 % en comparación con el 3,6 % informado para el clado de África Occidental. La MPXV del clado de África Central se identificó en casos que aparecieron en la República Democrática del Congo (RDC) y Sudán del Sur, mientras que los casos en Nigeria entre 2010 y 2019 parecían deberse al clado de África Occidental. Todos los casos notificados fuera de África, incluidos los que están actualmente en circulación, han sido causados por el clado de África occidental. Actualmente se está investigando 14 si los cambios genéticos en el genoma del MPXV podrían ser responsables de este brote actual.
4-Genética del virus
El virus existe en dos formas infecciosas distintas, el virus maduro intracelular y el virus con envoltura extracelular, que difieren en sus glicoproteínas superficiales e infectan las células a través de diferentes mecanismos. La replicación del MPXV es un proceso complejo pero generalmente se cree que es idéntica a otros ortopoxvirus. Los receptores de entrada para MPXV no se han identificado claramente, aunque se sugirió que la entrada viral depende de la cepa viral y el tipo de célula huésped e involucra múltiples receptores de superficie, incluido el sulfato de condroitina o el sulfato de heparán.

5-Patología de la viruela del mono
La infección por MPXV tiene un período de incubación de 5 a 21 días y los síntomas comunes incluyen fiebre (entre 38,5 °C y 40,5 °C), dolor de cabeza y mialgia. Una característica distintiva de la infección por MPXV es la presencia de inflamación en los ganglios linfáticos maxilares, cervicales o inguinales (linfadenopatía). En el brote reciente, un informe de Portugal sugirió que la linfadenopatía inguinal era más común que la linfadenopatía cervical y axilar. Las erupciones aparecen después del inicio de la fiebre, comenzando en la cara, la lengua y la cavidad oral (enantema) antes de extenderse por todo el cuerpo.
En las últimas etapas de la infección, las lesiones en la cavidad oral pueden causar dificultades para beber y comer. Sin embargo, en los brotes recientes, se han informado varias observaciones clínicas atípicas. En los pacientes HSH, estos incluyen la presencia de lesiones genitales que posteriormente se diseminaron a otros sitios del cuerpo, así como úlceras anales, y parece que las lesiones cutáneas pueden tener una distribución más limitada que la notificada en brotes anteriores.

6-Gravedad de la enfermedad
La gravedad de la enfermedad se puede clasificar utilizando el recuento de lesiones, ya que los recuentos de lesiones más altos se correlacionan con un mayor riesgo de complicaciones graves. Los pacientes con complicaciones graves pueden experimentar problemas respiratorios y gastrointestinales, encefalitis, septicemia e infecciones oculares que conducen a la pérdida permanente de la visión. Las lesiones cutáneas también aumentan la probabilidad de infecciones bacterianas dérmicas, especialmente en pacientes que no están vacunados contra la viruela. Las lesiones generalmente progresan a través de cuatro etapas: macular, papular, vesicular y pustular, antes de caer como costras. Los pacientes generalmente se consideran no contagiosos una vez que las lesiones se han formado costra. Sin embargo, se ha informado que las costras contienen cantidades significativas de ADN MPXV incluso después de caerse, lo que puede indicar la presencia de material viral infeccioso. Cabe señalar que se ha aislado un virus variólico viable de costras de pacientes con viruela.
Durante el embarazo, el MPXV puede transmitirse verticalmente de la madre al feto. En un estudio que involucró a cuatro mujeres embarazadas que estaban infectadas con MPXV en la República Democrática del Congo, solo una dio a luz a un bebé sano. Dos mujeres experimentaron un aborto espontáneo en el primer trimestre y una tuvo un mortinato. En otro estudio, cuatro de cada cinco mujeres infectadas con MPXV en la República Democrática del Congo tuvieron muerte fetal y se observaron lesiones en la superficie materna de la placenta. Los estudios no informaron con qué clado de MPXV estaban infectados estos pacientes, aunque dada la ubicación de los estudios es muy probable que sea el clado centroafricano.
Un estudio realizado en Zaire entre 1980 y 1985 informó una mayor incidencia de enfermedad mortal en niños pequeños infectados con MPXV, con una tasa de letalidad del 14,9 % en niños de 0 a 4 años en comparación con una tasa del 0 % en personas de 10 años. Actualmente, faltan datos sobre la gravedad de la infección en niños infectados con el clado de África occidental.

7-El camino del virus en el cuerpo
El resultado clínico de la infección ortopoxviral en un huésped vertebrado depende en gran medida de la ruta de entrada utilizada por el virus para establecer la infección primaria. Para varios ortopoxvirus, como el virus variólico altamente contagioso y el MPXV, la cavidad respiratoria/oral es una posible ruta de entrada común después de la inhalación de secreciones respiratorias en aerosol o la ingestión de fluidos corporales de personas infectadas. A continuación, el virus infecta las mucosas de las vías respiratorias y bucales, siendo el epitelio de las vías respiratorias superiores, medias e inferiores los principales objetivos de la infección primaria.
Esta fase de la infección es asintomática, sin signos de lesiones orofaríngeas. La propagación del virus progresa con la infección de las células inmunitarias residentes en los tejidos cercanos, que pueden incluir células presentadoras de antígenos, como monocitos, macrófagos, células B y células dendríticas. Los mecanismos por los cuales los ortopoxvirus se trasladan desde el sitio inicial de infección a los ganglios linfáticos de drenaje cercanos son un tema de debate.
Se ha observado, por ejemplo, que las células dendríticas murinas infectadas migran desde el epitelio pulmonar hacia los ganglios linfáticos de drenaje, lo que probablemente contribuya a la diseminación del virus. Después de la infección de los ganglios linfáticos de drenaje cercanos, los ortopoxvirus se replican ampliamente en los tejidos linfoides. Los estudios clínicos de la viruela del simio en humanos sugieren que los tejidos linfoides del cuello y la garganta son áreas de replicación primaria del MPXV. Tras el desarrollo de viremia primaria de bajo grado resultante de la infección de los tejidos linfoides, los ortopoxvirus pueden diseminarse a órganos distantes por vía linfohematógena. La presencia de ortopoxvirus en los pequeños vasos sanguíneos dérmicos marca el inicio de la infección cutánea y el desarrollo de lesiones cutáneas.

8-Transmisión de la enfermedad
El virus de la viruela del mono se transmite con mayor frecuencia a través del contacto directo con la erupción o las llagas de alguien que tiene el virus. También puede propagarse a través del contacto con la ropa, la ropa de cama y otros artículos utilizados por una persona con la enfermedad, o por las gotitas respiratorias que pueden transmitirse a través del contacto prolongado cara a cara. Aún no se conoce del todo el riesgo de transmisión por aerosol.
La enfermedad se puede propagar de persona a persona a través del contacto directo con fluidos corporales infecciosos o con el sarpullido, las costras y las llagas que puede causar la enfermedad. La propagación también puede ocurrir a través del contacto indirecto, como a través de ropa o ropa de cama contaminada con el virus. Otra de las formas es a través de las secreciones respiratorias durante el contacto cara a cara prolongado o durante el contacto físico íntimo, como los besos, las caricias o las relaciones sexuales.

9- Avances sobre la transmisión sexual
Se ha especulado sobre la transmisión sexual de la viruela del simio, y recientemente se identificó MPXV en el semen de tres pacientes masculinos en Italia. También se han informado casos de viruela del simio con lesiones genitales exclusivas, lo que podría indicar un tropismo preferencial del MPXV en los testículos. Al ser un tejido inmunoprivilegiado, los testículos podrían actuar como un sitio para la infección latente por MPXV, pero esto requiere más investigación. También se notificó excreción viral en las heces y el contacto con la mucosa rectal podría aumentar la probabilidad de transmisión del MPXV. Anteriormente se observó en pacientes con el virus de la inmunodeficiencia humana 1 (VIH-1) que estos tejidos podrían actuar como reservorio del virus.
Un estudio reciente determinó que el entorno inmunitario de la mucosa rectal en HSH era significativamente diferente en comparación con los individuos heterosexuales, con una mayor presencia de actividades inmunitarias indicativas de lesiones en la mucosa. Esta condición podría conducir al reclutamiento de células inmunitarias, que luego podrían ser atacadas fácilmente por agentes infecciosos, como se observa con el VIH-1. Esto podría aplicarse de manera similar a la transmisión e infección de MPXV en HSH. Sin embargo, esto no indica que la viruela del simio se haya convertido en una enfermedad de transmisión sexual, ya que el MPXV puede propagarse a través de cualquier forma de contacto cercano con las pústulas infecciosas que son sintomáticas de la viruela del simio.

10-Inmunidad a MPXV
Aunque el virus se identificó hace décadas, la inmunidad humana a la infección por MPXV no ha sido ampliamente caracterizada. Las células inmunitarias innatas normalmente actúan como la primera línea de defensa después de una infección viral activa, pero estas células también sirven como objetivos para algunos virus. Numerosos estudios in vitro e in vivo han demostrado que los monocitos son los objetivos iniciales de los poxvirus. Se ha sugerido que la detección temprana del antígeno del poxvirus tanto en los monocitos como en los neutrófilos es un fuerte predictor de la letalidad del MPXV. Los monocitos susceptibles se reclutan activamente en los sitios de infección, con una marcada expansión de monocitos CD14 + en los pulmones de los macacos cynomolgus que experimentan neumonía viral después de la infección por MPXV.
Las células asesinas naturales son un componente importante de la inmunidad innata y, al igual que los monocitos, son capaces de configurar la respuesta inmunitaria adaptativa. En los macacos rhesus infectados con MPXV, el número de células asesinas naturales se expande significativamente tanto en la sangre periférica (un aumento medio de 23 veces el día 7 después de la infección) como en los ganglios linfáticos.
En humanos infectados con MPXV, actualmente se desconocen las funciones de muchas células inmunitarias innatas, incluidos monocitos/macrófagos, neutrófilos, células asesinas naturales, células dendríticas convencionales, células dendríticas plasmocitoides y células linfoides innatas. La caracterización y el perfilado de estas células inmunitarias durante la infección por MPXV serán esenciales para comprender sus funciones e identificar biomarcadores importantes para el pronóstico de la enfermedad.
SEGUIR LEYENDO:
Últimas Noticias
Las cicatrices en el corazón tras un infarto no son todas iguales y eso es clave para el tratamiento
Investigadores del Instituto Weizmann de Israel revelaron las diferencias que dejan en el tejido cardíaco. Descubrieron que existen dos tipos de fibrosis con mecanismos biológicos distintos

Alertan que la próxima epidemia transmitida por mosquitos podría no ser por el virus del dengue
Un equipo científico internacional advirtió sobre el posible desarrollo de brotes por arbovirus poco conocidos en América Latina. Por qué podrían propagarse aun más

Por qué el asteroide 2024 YR4 podría impactar contra la Luna y qué consecuencia tendría
El choque del cuerpo celeste en la superficie selenita generaría una explosión equivalente a 340 bombas de Hiroshima y dejaría un cráter de hasta 2 kilómetros de diámetro. Expertos explican qué sucedería y cómo nos afectaría

Guía para prevenir el Alzheimer: 14 estrategias para aplicar antes de los 50 años
Si bien hay factores de riesgo que no se pueden modificar, existen cambios clave en el estilo de vida a edades tempranas que reducen las probabilidades de padecer esta enfermedad y otras demencias. Cómo los jóvenes deben proteger su cerebro, según los expertos

Descubrieron en Australia fósiles del mega-ráptor más antiguo del mundo, lo que cambiaría el panorama sobre el cretácico
Un hallazgo en la región de Victoria revela datos sobre ecosistemas antiguos. Ponen a prueba teorías previas sobre jerarquías y distribución de especies prehistóricas




