
Das Pharmaunternehmen Moderna gab heute die vorläufigen Ergebnisse seines Covid-19-Impfstoffs für Kinder unter 6 Jahren bekannt. Das Unternehmen gab bekannt, dass zwei 25-Mikrogramm-Dosen seines Covid-19-Impfstoffs für Kinder im Alter von 6 Monaten bis 5 Jahren eine Immunantwort ähnlich zwei 100-Mikrogramm-Dosen für Erwachsene im Alter von 18 bis 25 Jahren zeigten, was darauf hinweist, dass der Nutzen für junge Erwachsene auch jungen Erwachsenen zugute kommt Kinder.
Die Ergebnisse wurden aus der Analyse auf der Grundlage einer Gruppe von 6.900 Kindern im Alter von 6 Monaten bis 5 Jahren erhalten.
Die meisten Nebenwirkungen waren leicht oder mittelschwer und traten nach der zweiten Injektion häufiger auf. Das Unternehmen stellte fest, dass keine Todesfälle oder Fälle von Myokarditis oder Perikarditis gemeldet wurden. Myokarditis ist eine Entzündung des Herzmuskels und Perikarditis ist eine Entzündung der Herzschleimhaut.
Die beiden Dosen des Impfstoffs werden Kindern im Abstand von 28 Tagen verabreicht. Die Daten zeigten „eine starke neutralisierende Antikörperreaktion“ und „ein günstiges Sicherheitsprofil“, so die heute veröffentlichte Erklärung des Pharmaunternehmens.
Angesichts dieser guten Ergebnisse wird Moderna die US-amerikanische Food and Drug Administration (FDA) auffordern, die Verwendung des pädiatrischen Impfstoffs für Kinder im Alter von 6 Monaten bis 5 Jahren in den kommenden Wochen zu genehmigen.
Stéphane Bancel, CEO von Moderna, erwartete, dass „wir angesichts der Notwendigkeit eines COVID-19-Impfstoffs bei Säuglingen und Kleinkindern mit der US-amerikanischen FDA und den Aufsichtsbehörden auf der ganzen Welt zusammenarbeiten, um diese Ergebnisse so schnell wie möglich zu übermitteln. Wir glauben, dass diese jüngsten Ergebnisse eine gute Nachricht für Eltern von Kindern unter 6 Jahren sein werden.“

Weniger wirksam gegen Ómicron
Der Impfstoff war nicht so wirksam bei der Vorbeugung von COVID-19-Infektionen, die durch die Ómicron-Variante verursacht wurden, die während der Studie in den USA und der Welt vorherrschte. Bei Kindern im Alter von 6 Monaten bis 1 Jahr betrug die Wirksamkeit gegen Omicron 43,7% und bei Kindern im Alter von 2 bis 5 Jahren 37,5%. Moderna erklärte, dass die geringere Wirksamkeit immer noch statistisch signifikant sei und mit der Leistung von Erwachsenen übereinstimme, die mit der Ómicron-Variante geimpft wurden.
Das US-amerikanische Pharmaunternehmen bewertet das Potenzial eines Auffrischungsimpfstoffs für alle Kinder ab 6 Monaten, der auf die erstmals in Wuhan entdeckte Version des Coronavirus sowie auf die Ómicron-Variante abzielt.
Moderna gab außerdem bekannt, dass es bereits bei der FDA einen Antrag auf Zulassung der Verwendung des Covid-19-Impfstoffs des Unternehmens für Kinder im Alter von 6 bis 11 Jahren gestellt hat. Kinder in diesem Alter erhielten zwei Injektionen einer größeren 50-Mikrogramm-Version des Impfstoffs.
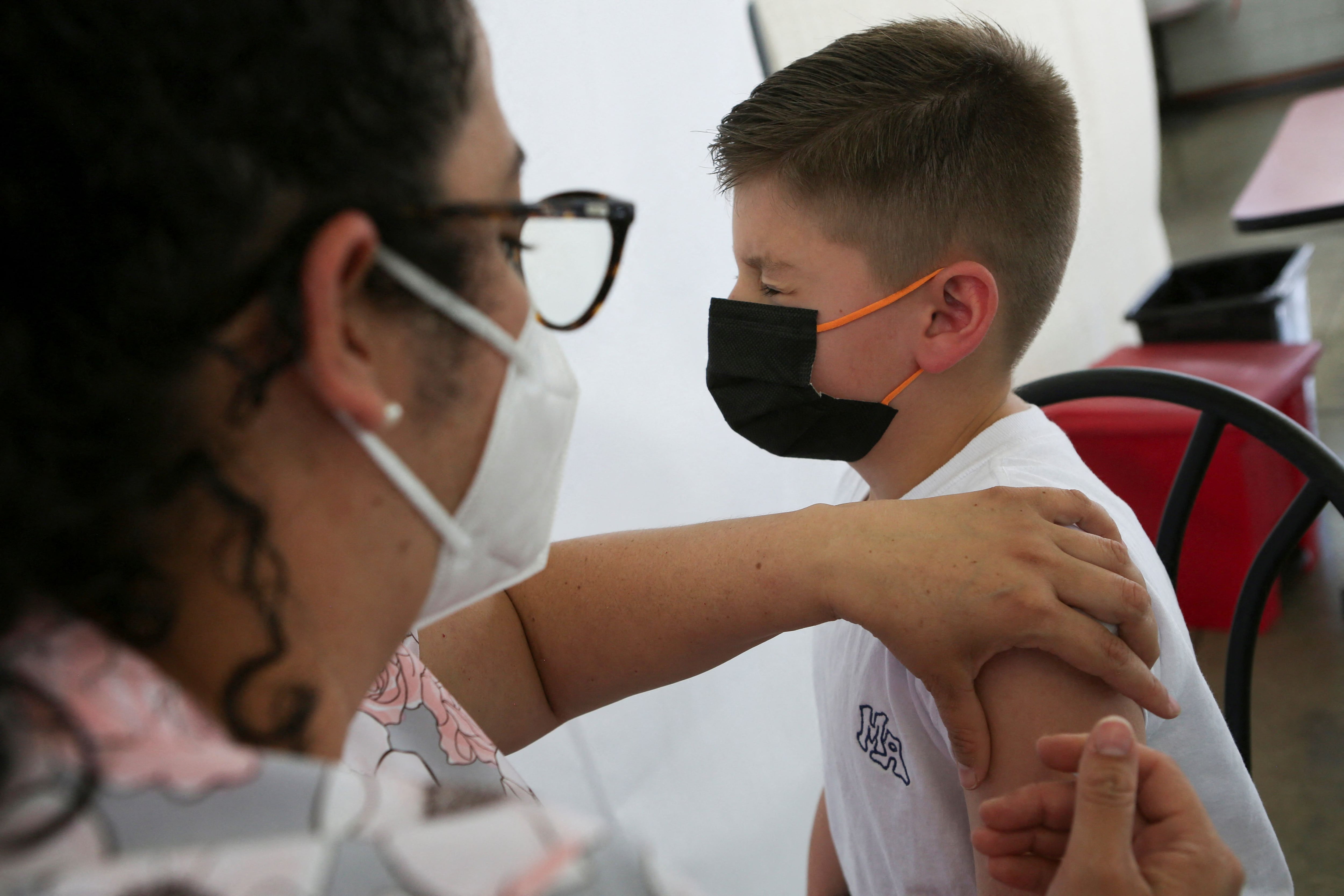
Das Unternehmen stellte fest, dass es der FDA zusätzliche Folgedaten zu seinem Impfstoff für Kinder im Alter von 12 bis 17 Jahren zur Verfügung gestellt hat. Kinder in diesem Alter erhielten zwei Injektionen einer größeren 100-Mikrogramm-Version des Impfstoffs.
Im vergangenen Monat verschob die FDA ein Treffen ihrer Impfstoffberater, um den COVID-19-Impfstoff von Pfizer/BioNTech für Kinder unter 5 Jahren zu prüfen, und forderte zusätzliche Daten zu dritten Dosen an. Die Unternehmen gehen davon aus, dass die Daten Anfang April vorliegen werden.
LESEN SIE WEITER:
Más Noticias
Debanhi Escobar: Sie sicherten sich das Motel, in dem sie leblos in einer Zisterne gefunden wurde

Die älteste Person der Welt starb im Alter von 119 Jahren

Makabrer Fund in CDMX: Sie ließen eine Leiche verpackt und in einem Taxi festgebunden
Die Adler Amerikas werden in einem Duell der Legenden auf Manchester City treffen. Hier sind die Einzelheiten

Das FBI hat vor dem Krieg Häuser überfallen, der mit Putin verbunden war

