
Como aconteceu meses atrás em vários países ao redor do mundo, em 4 de janeiro, a Administração Nacional de Medicamentos, Alimentos e Tecnologia Médica ( ANMAT) aprovou o uso individual de quatro testes de autoavaliação baseados na detecção do vírus SARS-CoV-2.
Os produtos aprovados Panbio COVID-19 Antigen Self-Test, SARS-CoV-2 Antigen Self Test Nasal, SARS-CoV-2 Antigen Rapid Test (COVID-19 Ag) e WL Check SARS-CoV-2 Ag Self Testing Os produtos pertencem aos laboratórios Abbott, Roche, Vyam Group e Wiener e são vendidos exclusivamente em farmácias. Eles servem como orientação diagnóstica e os próprios usuários devem coletar a amostra com base nas instruções indicadas pelos fabricantes em cada produto.
“É importante esclarecer que esses testes fornecem resultados indicativos, sem valor diagnóstico conclusivo, exceto que as jurisdições, de acordo com o Ministério da Saúde da Nação e com base na situação epidemiológica, consideram o resultado positivo. Diferentemente dos testes de uso profissional em que a amostra é coletada no nível nasofaríngeo, no caso de testes de autoavaliação ela é realizada no nível nasal ou por saliva, conforme especificado pelo fabricante. Nesse sentido, é muito importante que a amostragem seja realizada corretamente e que o teste seja realizado imediatamente para evitar resultados errôneos”, disse Anmat naquela ocasião.
Quanto à sua eficácia, esclareceram: “É necessário ter em mente que se a pessoa não apresentar sintomas ou se a carga viral for baixa (o que pode ocorrer durante os dias iniciais ou finais da infecção) o SARS-CoV-2 pode não ser detectado pelo teste, portanto, um resultado negativo não descarta infecção. Para serem acompanhados, os resultados devem ser relatados imediatamente (com base no código de barras de cada pacote) após a realização do teste, e um período mais longo estará disponível quando não tiver sido usado, seja pelo usuário individual ou por um oficial de relatórios no caso de um grande volume de testes”.
Especialistas apontam que além do método escolhido, o que deve ser levado em consideração é o tipo de teste que será feito. Não, como é feito. Os testes realizados pela tecnologia de PCR (especificamente RT-PCR) são mais eficazes do que os testes de antígenos, sejam eles realizados com saliva ou amostra nasofaríngea. Portanto, as autoridades de saúde recomendam fazer um teste de PCR após o teste positivo para um teste pessoal em casa para confirmar se eles têm COVID-19. Os especialistas consideram o teste como “uma ferramenta de saúde pública muito útil” para impedir a propagação da doença. Esses testes são amplamente usados em casa, em locais de trabalho e escolas em grande parte do mundo.
Pesquisadores da Universidade de Liverpool, da Universidade de Harvard e da Universidade de Bath destacam em um artigo no The Lancet, que o teste de antígeno (LFT) funciona de uma forma muito diferente da polimerase testes de reação em cadeia (PCR) e não podem ser comparados.
“O teste de antígeno não requer nenhum instrumento ou equipamento adicional, o que o torna altamente portátil e pode ser usado em uma ampla variedade de ambientes de saúde no chamado ponto de atendimento e triagem” explicou à Infobae o infectologista Eduardo López (MN 37586), chefe do Departamento de Medicina do Ricardo Gutiérrez. Hospital infantil.
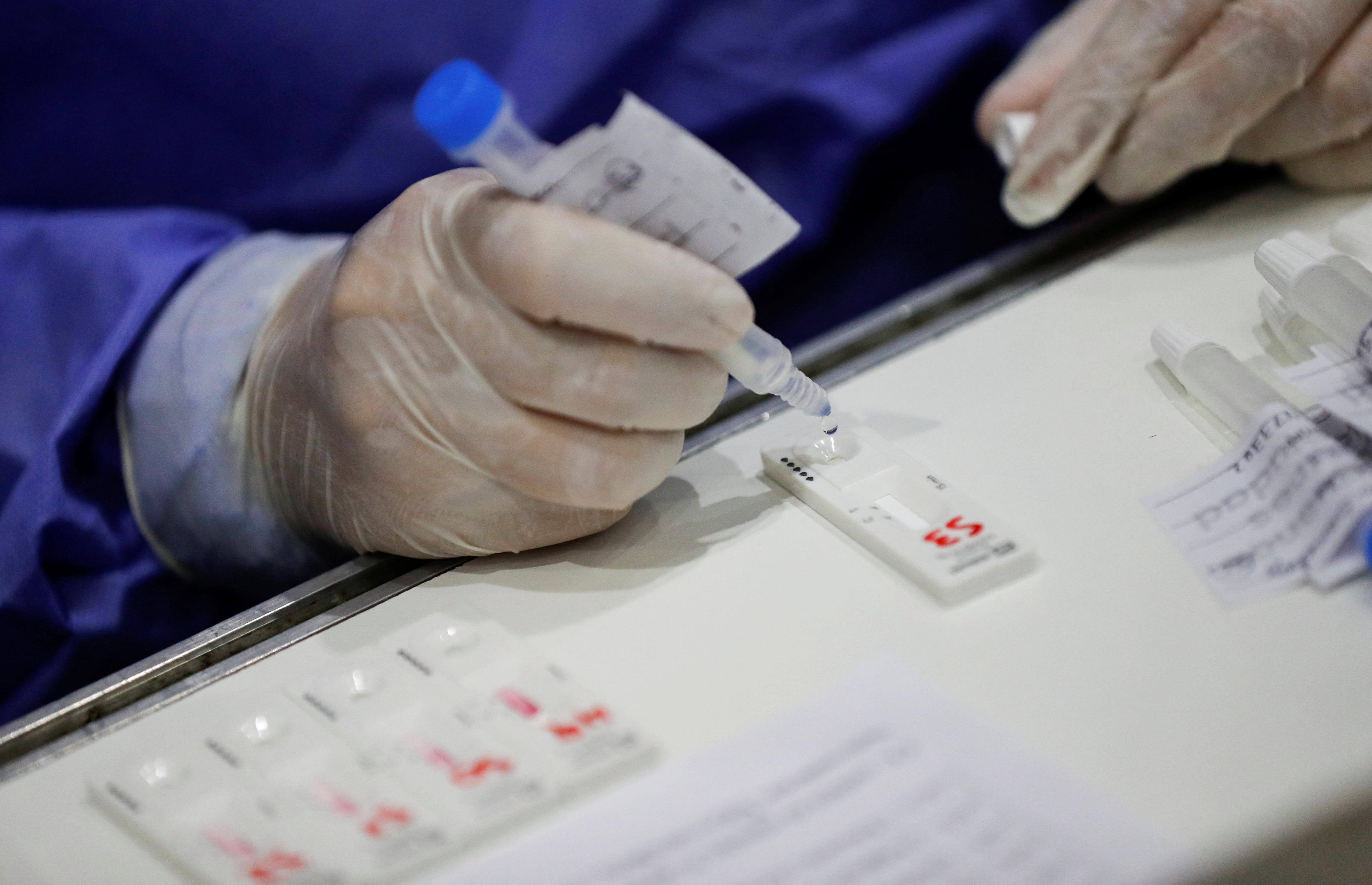
Esse teste permite grandes benefícios aos departamentos de emergência, o que permitiria a rápida identificação de surtos e continha a disseminação de infecções. O teste rápido de antígeno detecta a proteína nucleocapsídeo do vírus. Essa proteína é encontrada na superfície da estrutura do vírus, então a presença do vírus é encontrada muito mais rapidamente. A partir daí, o resultado está em alguns minutos. Em contraste, o teste de PCR procura a presença de material genético do vírus. No entanto, “o teste rápido não substitui a PCR, mas é uma alternativa muito boa para a necessidade de um diagnóstico rápido ou quando os diagnósticos de PCR não estão disponíveis”, explica López. E acrescenta: “O Ministério da Saúde reconhece esses métodos com critérios diagnósticos devido à sua alta especificidade quando são positivos”.
Os LFTs detectam material de proteínas na superfície do vírus e são muito propensos a testar positivo quando alguém é infeccioso, enquanto os testes de PCR detectam o material genético do vírus, que pode estar presente por semanas após a pessoa não ser mais infecciosa.
O infectologista Ricardo Teijeiro, por sua vez, disse à Infobae: “Desde o início da pandemia havia diferentes qualidades de testes de antígenos. Dois anos depois, podemos dizer que os testes atuais de antígenos provenientes de laboratórios reconhecidos são altamente eficazes e comparados aos testes feitos com PCR. É por isso que eles provaram ser muito eficazes.”
María del Mar Tomas, microbiologista do Hospital A Coruña, pesquisadora do INIBIC e porta-voz do SEIMC argumenta que “a saliva é uma amostra muito eficaz para a detecção da variante Ómicron se usarmos a tecnologia PCR (especificamente RT-PCR) ou técnicas inovadoras como CRISPR-Cas”, embora ela aponte fora que os testes de antígeno na saliva “são menos eficazes e têm uma menor sensibilidade”. O Omicron pode ser transmitido quando infectou a garganta e a saliva, antes que o vírus atinja o nariz, portanto, passar um cotonete pelas narinas no início da infecção não o detectará.
Em um estudo recente nos Estados Unidos, testes de PCR com saliva de 29 pessoas infectadas com Omicron detectaram o vírus em média três dias antes que as amostras de nariz testassem positivo para testes de antígeno, ou os chamados fluxo lateral. Em geral, os testes rápidos têm uma sensibilidade menor do que os testes de PCR processados em laboratório, o que significa que eles produzem mais falsos negativos. Mas se o resultado for positivo, é quase certo que seja COVID-19, o que torna o teste de antígeno uma ferramenta poderosa para lidar com a pandemia.
Análise de variantes
Os testes COVID procuram pequenos fragmentos do vírus. Por exemplo, é comum que os testes de antígenos contenham anticorpos que se ligam a proteínas, ou antígenos, que estão na superfície do vírus.
Mas as mutações do vírus podem mudar a forma dessas proteínas e dificultar a adesão dos anticorpos, resultando em falsos negativos. Assim, em janeiro de 2021, pesquisadores do Center for the Development of Technologies Designed with Microsystems for Point-of-Care em Atlanta, EUA, começaram a trabalhar com o NIH e a FDA para avaliar o desempenho de dezenas de produtos já autorizados com as novas variantes.
Experimentos de laboratório inicialmente levantaram preocupações sobre a sensibilidade de alguns testes de antígenos com a variante Ómicron, mas os testes parecem funcionar melhor no mundo real do que em laboratório.
Desde o outono, quando o governo de Joe Biden anunciou planos para fornecer às pessoas acesso a testes em casa, os cientistas também têm ajudado a tornar a liberação da FDA mais rápida para produtos que podem ser fabricados em grandes volumes, incluindo Testes da Siemens e SD Biosensor. Cientistas de Atlanta e do governo federal criaram um modelo melhor e mais ágil: uma maneira sistemática de uma parte independente examinar os produtos, garantir sua qualidade e agilizar a aprovação de quem passar no exame, para que cheguem às mãos dos consumidores mais rápido.
Esse trabalho foi “crucial”, de acordo com Michael Mina, epidemiologista aposentado de Harvard e atual diretor científico da eMed, que vende testes caseiros. Normalmente, os desenvolvedores de testes precisam coletar seus próprios dados e seguir o processo regulatório. “É uma nova abordagem que os Estados Unidos poderiam adotar na avaliação de ferramentas de diagnóstico”, disse Mina.
O programa de Diagnóstico Rápido (ou RADx), que visa ajudar os desenvolvedores de testes COVID a refinar, comercializar e aumentar a disponibilidade de seus produtos. Até agora, apoiou 29 fabricantes que receberam 40 autorizações da FDA para testes COVID, incluindo sete produtos de venda livre; e todos foram avaliados pela equipe de Atlanta.
“Não há dúvida de que o programa RadX acelerou o desenvolvimento da categoria de diagnósticos domésticos”, escreveu Sean Parsons, CEO da Ellume, em um e-mail. “O programa impulsionou anos de avanço em inovação e desenvolvimento.”
CONTINUE LENDO:
Más Noticias
Debanhi Escobar: eles garantiram o motel onde ela foi encontrada sem vida em uma cisterna

A pessoa mais velha do mundo morreu aos 119 anos

Achado macabro no CDMX: deixaram um corpo ensacado e amarrado em um táxi
As águias da América enfrentarão o Manchester City em um duelo de lendas. Aqui estão os detalhes

Por que é bom trazer cães para conhecer o mundo quando eles são filhotes

