
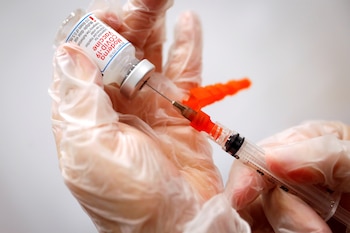
La biotecnológica estadounidense Moderna anunció este martes que ha solicitado a la Agencia Europea de Medicamentos que autorice el uso de su vacuna contra el COVID-19 para niños de 6 a 11 años con dosis más bajas que las de los adultos.
En un comunicado, Moderna dijo que ha solicitado una “variación” para la Autorización de Comercialización Condicional (CMA, en inglés) que tiene su vacuna en la Unión Europea para “incluir” una pauta de dos dosis de 50 microgramos para niños en esa franja de edad.
La firma con sede en Boston ha hecho la petición basándose en unos resultados publicados a finales de octubre del estudio clínico de su vacuna en pacientes pediátricos, llamado “KidCOVE”, que arrojaron datos prometedores en el rango de 6 a 11 años, agrega.
“Esta es la primera solicitud para el uso de nuestra vacuna en este grupo de edad”, dijo en un comunicado el consejero delegado de la empresa, Stéphane Bancel, quien aseguró que próximamente entregará esos datos a las agencias reguladoras en el resto del mundo.
Moderna indica en la nota que la eficacia de la vacuna fue del 80% dos semanas después de la primera dosis en los niños en la franja de edad señalada infectados con SARS-CoV-2, independientemente de sus síntomas.
A principios de mes, EEUU autorizó la vacuna de Pfizer-BioNTech en dos dosis de 10 microgramos para niños entre 5 y 11 años.
Desaconsejo en Francia
La autoridad sanitaria francesa ha recomendado que los menores de 30 años reciban la vacuna contra el COVID-19 de Pfizer en lugar de la vacuna de Moderna.
La Haute Autorité de Santé (HAS), que no tiene poder legal para prohibir o autorizar medicamentos, pero que actúa como asesora del sector sanitario francés, citó riesgos “muy poco frecuentes” relacionados con la miocarditis, una enfermedad del corazón, que habían aparecido en datos recientes sobre la vacuna Moderna y en un estudio francés publicado el lunes.
“Dentro de la población menor de 30 años, este riesgo parece ser unas cinco veces menor con la inyección Comirnaty de Pfizer en comparación con la inyección Spikevax de Moderna”, dijo la HAS en su dictamen publicado el lunes.
La HAS dijo que su recomendación, que se aplicaría independientemente del uso de la vacuna como primera, segunda o tercera dosis de “refuerzo”, sería válida hasta que se conozcan más resultados científicos al respecto.
Sin embargo, para los mayores de 30 años, la autoridad recomendó explícitamente el uso de la vacuna Moderna, afirmando que su eficacia era ligeramente superior.
El mes pasado, el organismo regulador de los medicamentos de la Unión Europea aprobó la vacuna de refuerzo de Moderna, afirmando en su revisión que la inyección puede administrarse a personas de 18 años o más, al menos seis meses después de la segunda dosis.
(Con información de EFE y Reuters)
SEGUIR LEYENDO:
Últimas Noticias
Zelensky y Austin pidieron a Trump para que mantenga el apoyo militar a Ucrania
Advirtieron que suspender la ayuda ahora “solo invitará más agresión, caos y guerra”

Giorgia Meloni defendió a Elon Musk de las críticas: “¿El problema es que es influyente y rico o que no es de izquierda?“
La primera ministra italiana dijo que el magnate ejerce su derecho a la libertad de expresión. En cambio, acusó a poderosos de la izquierda de injerencia política, entre ellos el multimillonario George Soros

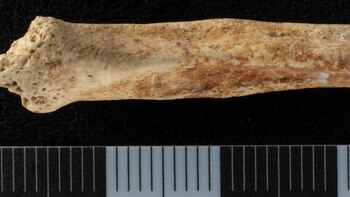
Un grupo de arqueólogos halló en un pozo en Londres un hueso de pene de perro de la época romana
Este descubrimiento, pintado con ocre rojo, planteó nuevas preguntas sobre los rituales y creencias de las antiguas comunidades en Gran Bretaña
Caos en Chad: 19 muertos en un sangriento asalto al palacio presidencial
Un grupo armado con cuchillos atacó sorpresivamente la sede de gobierno en Yamena, resultando en la muerte de 18 asaltantes y un soldado. El incidente ocurrió horas después de la visita del canciller chino y en medio de tensiones post-electorales

Rumanía detectó el primer caso de HMPV en una mujer que no viajó al extranjero
La paciente de 67 años presentó los primero síntomas el 26 de diciembre, ahora se encuentra hospitalizada, aislada y en estado estable



