Pfizer y BioNTech pidieron el lunes a las autoridades sanitarias de Estados Unidos autorización para su vacuna anticovid dirigida específicamente a la variante Ómicron para niños de 5 a 11 años, anunciaron los dos grupos en un comunicado de prensa.
La solicitud de autorización de emergencia a la FDA, la agencia estadounidense de medicamentos, es para una dosis de refuerzo de 10 microgramos.
En caso de una respuesta positiva de la FDA, los Centros para la Prevención y el Control de Enfermedades (CDC), la principal agencia federal de salud del país, deberán emitir sus recomendaciones antes de que se administren las primeras inyecciones a los niños.
Una solicitud de autorización similar será enviada en los próximos días a la Agencia Europea de Medicamentos (EMA), especifica el comunicado de prensa.
La nueva generación de vacuna anticovid, llamada bivalente, se dirige tanto a la cepa original del coronavirus como a los linajes BA.4 y BA.5 de la variante Ómicron, que actualmente representan más del 90% de las infecciones en Estados Unidos.
Si bien los niños se han visto menos afectados por el COVID-19 que los adultos, varios cientos de menores de 5 a 18 años han muerto en Estados Unidos desde el inicio de la pandemia, según cifras de los CDC.
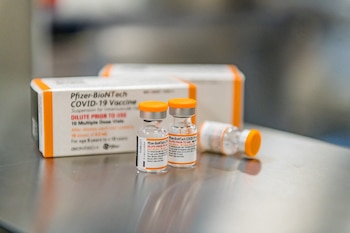
A fines de agosto, la FDA autorizó las versiones de las vacunas de Pfizer-BioNTech y Moderna dirigidas a Ómicron, y los CDC las recomendaron luego, allanando el camino para una nueva campaña de vacunación.
Pero solo las personas mayores de 12 años, para la vacuna Pfizer-BioNTech, y de 18 años para la vacuna Moderna, están autorizadas por el momento para recibir esta dosis específica de refuerzo.
Las vacunas modificadas realizadas por Pfizer y su rival Moderna ofrecen a los estadounidenses la oportunidad de obtener la protección más actualizada en otro período crítico de la pandemia. Son inyecciones combinadas o “bivalentes”: la mitad de la vacuna original y la mitad de la protección contra las versiones omicron BA.4 y BA.5 que ahora causan casi todas las infecciones por COVID-19.
“Creo que van a ser una herramienta eficaz para la prevención de enfermedades este otoño y durante el invierno”, dijo el Dr. Matthew Daley, asesor de los CDC de Kaiser Permanente Colorado.
Al comparar el ajuste que se ha estudiado en personas y el que en realidad usarán los EEUU, “es el mismo andamiaje, parte del mismo techo, solo estamos colocando algunas buhardillas y ventanas”, dijo la Dra. Sarah Long de Drexel. Universidad.
Las vacunas actualizadas son solo para usar como refuerzo, no para las primeras vacunas de alguien.
(Con información de AFP y AP)
Seguir leyendo:
Últimas Noticias
¿Qué hacer en Miami cuando llueve? Las mejores actividades

Cómo conocer gente en Miami: ¿qué hacer y dónde ir?

“Tina”: el conmovedor documental con el que Tina Turner se despidió del público
Las 6 mejores playas de Miami donde puedes llevar a tu perro

El Festival Gay8, en la Pequeña Habana de Miami, une orgullo latino y LGBT+







