
El laboratorio biotecnológico Moderna ampliará su capital mediante la emisión de hasta un máximo de 20,6 millones de acciones ordinarias, equivalentes al 5,45% de su capital, cuyo importe alcanzaría los USD 1.340 millones al precio de 76 dólares por acción establecido por la compañía, lo que representa un descuento del 5% respecto del precio de cierre en la sesión de ayer.
La compañía, que este lunes anunció resultados “prometedores” en los ensayos clínicos en fase 1 llevados a cabo con su compuesto mRNA-1273 como potencial candidato a convertirse en vacuna contra el coronavirus SARS-CoV-2, destinará los fondos levantados mediante la operación a cubrir las necesidades de capital circulante relacionadas con la fabricación del compuesto y su distribución dentro y fuera de Estados Unidos, asumiendo que lograse todos los permisos necesarios.
En un primer momento, Moderna venderá 17,6 millones de nuevas acciones ordinarias a un precio de 76 dólares, lo que elevaría a 1.250 millones de dólares el importe de la operación, que se cerrará el próximo 21 de mayo.

Sin embargo, la compañía ha otorgado a los suscriptores de la transacción el derecho de adquirir 2,64 millones de acciones adicionales en un periodo de 30 días, lo que incrementaría a 1.340 millones de dólares el importe de la ampliación de capital.
Los títulos de Moderna, que el lunes subieron casi un 20% en la bolsa, moderaron este martes las ganancias, y el valor retrocedía un 2,8%, hasta los 77,73 dólares. En lo que va de año, las acciones de Moderna se han revalorizado un 300%, incluyendo un 200% desde el pasado mes de marzo.
Moderna, fundada hace nueve años, dijo que la vacuna había sido “en general bien tolerada” y que los pacientes no sufrieron más que enrojecimiento o dolor por las inyecciones.
Moderna comenzó las pruebas en humanos el 16 de marzo, en tres grupos de 15 voluntarios recibieron tres dosis diferentes, con un refuerzo 28 días después. En vista de los primeros resultados, los científicos decidieron eliminar la dosis más alta del resto de las pruebas, ya que las dosis más bajas parecían tener un efecto. Esto permitiría vacunar a más personas, a igual producción. En pruebas separadas con ratones se vio que la vacuna evita que el virus se replique en los pulmones, dijo el lunes la compañía.
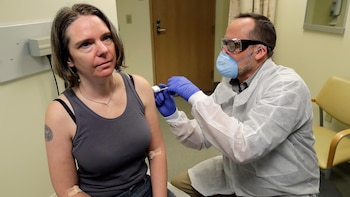
La Fase 2, de 600 personas, ya recibió luz verde de la Agencia Estadounidense de Medicamentos (FDA) y debería comenzar en junio. La Fase 3, que generalmente se realiza en miles de personas, debería comenzar en julio, dijo Stephen Hoge, presidente de Moderna.
La vacuna fue desarrollada en asociación con el Instituto Nacional de Alergias y Enfermedades Infecciosas (NIAID), dirigido por el muy respetado virólogo Anthony Fauci, principal asesor de Trump en esta pandemia. Este centro también está llevando a cabo el ensayo clínico.
Moderna, con sede en Cambridge, cerca de Boston, hasta ahora nunca ha recibido una licencia de medicamentos o vacunas.
En todo el planeta, solo han comenzado 12 ensayos clínicos para una inmunización contra la COVID-19, la mitad en China, de cerca de un centenar de proyectos identificados, según la Escuela de Higiene y Medicina Tropical de Londres (LSHTM, por sus siglas en inglés).
Washington invirtió temprano en el proyecto de Moderna, así como en otros menos avanzados, del grupo estadounidense Johnson & Johnson y del laboratorio francés Sanofi, que tiene sitios de producción en Estados Unidos.
El problema no es solo identificar una vacuna efectiva y segura, sino que será necesario fabricar miles de millones de dosis y distribuirlas en un orden que aún debe negociarse internacionalmente.
Los principales laboratorios, incluido Moderna, han dicho que comenzarían a producir millones de dosis sin esperar los resultados de los ensayos clínicos, una toma de riesgos sin precedentes, financiados en gran medida por los Estados y las grandes organizaciones no gubernamentales.
Moderna anunció recientemente una asociación con la multinacional suiza Lonza para fabricar hasta 1.000 millones de dosis por año.
(Con información de Europa Press y AFP)
MÁS SOBRE ESTE TEMA:
Últimas Noticias
¿Qué hacer en Miami cuando llueve? Las mejores actividades

Cómo conocer gente en Miami: ¿qué hacer y dónde ir?

“Tina”: el conmovedor documental con el que Tina Turner se despidió del público
Las 6 mejores playas de Miami donde puedes llevar a tu perro

El Festival Gay8, en la Pequeña Habana de Miami, une orgullo latino y LGBT+







