
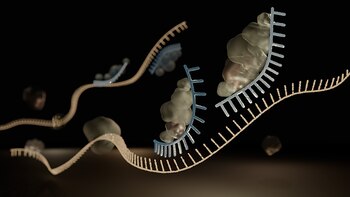
Los microARN son moléculas muy pequeñas que influyen en las instrucciones para la vida -es decir, en el control de los genes- dentro de los organismos, incluidos los seres humanos.
Este año 2024 la Asamblea Nobel del Instituto Karolinska de Suecia concedió el Premio Nobel de Medicina 2024 a los científicos estadounidenses Victor Ambros y Gary Ruvkun por el “descubrimiento del microARN y su papel en la regulación génica postranscripcional”.
Fue un hallazgo de investigación básica que hoy está ayudando a desarrollar tests de diagnóstico y tratamientos para diferentes enfermedades, desde el cáncer y el hígado graso hasta la esclerosis lateral amiotrófica, más conocida como ELA, y la enfermedad de Alzheimer.

Los microARN son un tipo de ácido ribonucleico (ARN) que se encuentra en las células. Los doctores Ambros y Ruvkun revelaron un principio completamente nuevo de la regulación de los genes que resultó ser esencial para los organismos pluricelulares.
Ahora se sabe que el genoma humano codifica más de 1.000 microARN. Los ganadores del Nobel publicaron sus hallazgos, por separado, en 1993 en la revista Cell a partir del estudio de un gusano redondo, llamado C. elegans, de 1 milímetro de longitud.
Manuel de la Mata, investigador del Instituto de Fisiología, Biología Molecular y Neurociencias, que depende del Conicet y la Universidad de Buenos Aires (UBA), comentó a Infobae: “Me parece maravilloso que hayan reconocido con un Nobel a los descubridores de los microARN. Puede estar sesgada mi opinión porque trabajo en ese campo, pero me parece que se lo merecían”.
Hace mucho que se esperaba que les dieran el premio. “Contribuyeron a un cambio de paradigma en el conocimiento de la regulación de la expresión de los genes”, enfatizó.
Actualmente, el doctor de la Mata estudia cómo es el metabolismo de los microARN. “Estas moléculas intervienen en diferentes procesos biológicos y se los estudia para desarrollar diagnósticos menos invasivos y tratamientos”, afirmó.
Qué se investiga sobre microARN en el hígado

En diálogo con Infobae, la científica Silvia Sookoian, investigadora del Conicet y decana de la Facultad de Ciencias de la Salud de la Universidad Maimónides, en Buenos Aires, Argentina, contó: “Lo más revolucionario del descubrimiento de los ganadores del Nobel de Medicina 2024 es que una vez son liberados a la circulación, los microARN funcionan como hormonas, lo que se conoce como un sistema “simil endocrino”.
Son moléculas muy pequeñas y estables. “Su estudio ha permitido comprender mejor muchas enfermedades, y se investigan como biomarcadores o como potenciales tratamientos”, resaltó.
Junto con Carlos Pirola y otros colegas, Sookoian estudió los microARN y su relación con enfermedades del hígado. Se enfocó en cómo están involucrados en lo que se conoce popularmente como “hígado graso” (o en términos médicos enfermedad hepática esteatósica asociada a disfunción metabólica). Lo publicaron en la revista Gut, de la Sociedad de Gastroenterología del Reino Unido.
El estudio de los microARN le sirvió a su equipo para entender cómo funcionan en el trastorno del hígado graso y usarlo como biomarcador en la circulación cuando la enfermedad está más avanzada.
“En colaboración con investigadores de la Universidad de Virginia, Estados Unidos, pudimos usar una técnica que nos permitió ver dónde están localizados en el hígado enfermo. También pudimos entender cómo se liberan los microARN a la circulación”, precisó Sookoian.
Cómo la investigación en microARN ayudaría para trastornos del cerebro

Por su parte, Elena Avale junto a su equipo del laboratorio de Terapéutica Experimental de Enfermedades Neurodegenerativas del Instituto de Investigaciones en Ingeniería Genética y Biología Molecular “Dr. Héctor N. Torres”, que depende del Conicet de la Argentina, recientemente modificó un tipo de microARN que sintetiza el cerebro humano de manera endógena y que tiene la capacidad de silenciar la expresión de ciertos genes.
“Esta herramienta se generó en el marco de una investigación que busca desarrollar tratamientos para la enfermedad de Alzheimer, algunos tipos de Parkinson atípico, demencia frontotemporal, parálisis progresiva y otras”, detalló Avale a Infobae.
Con su grupo, la científica eligió un microARN natural y lo modificó por técnicas de ingeniería genética para dotarlo con dos propiedades: por un lado, buscaron que tuviera capacidad de silenciar el gen codificante para la proteína Tau, cuya acumulacion patológica genera la muerte neuronal.
Por otro lado, el equipo de investigadores dirigió la expresión mediante vectores virales para que la molécula de microARN terapéutico se expresara únicamente en regiones cerebrales en las que comienza a acumularse la proteína Tau de manera tóxica.
“En modelos experimentales demostramos que la estrategia podría funcionar como una potencial terapia”, expresó. Los resultados se publicaron en la revista Molecular Therapy. Actualmente están realizando más investigaciones para confirmar si esa línea de trabajo podría resultar en tratamientos más precisos y efectivos para las enfermedades neurodegenerativas conocidas como taupatías.
Cómo detectar la ELA más temprano

En tanto, la ELA es una enfermedad que afecta a las neuronas del cerebro y la médula espinal, llevando a una parálisis progresiva que eventualmente impide caminar, hablar y moverse. El diagnóstico puede tardar hasta un año, lo que complica el inicio temprano del tratamiento. Además, las tasas de diagnóstico erróneo pueden alcanzar hasta el 68%, lo que dificulta aún más el manejo adecuado de la enfermedad.
En setiembre pasado, se difundió un nuevo avance en el diagnóstico de la ELA podría transformar la forma en que se detecta esa enfermedad. Investigadores del Brain Chemistry Labs, una organización sin fines de lucro ubicada en Jackson Hole, Wyoming, Estados Unidos, hicieron un test de sangre que promete identificar la ELA con una precisión del 98%. Se publicó en la revista Brain Communications de Oxford University Press.
El nuevo test se basa en el análisis de secuencias de microARN extraídas de vesículas diminutas liberadas por el cerebro y el sistema nervioso. Estas secuencias permiten identificar un “perfil de ELA” único.

En cuanto al cáncer, este año también se dio un paso importante en relación a los microARN. En la revista Nucleic Acid Research Se dio a conocer una lista que busca servir como referencia estándar para estudios experimentales y computacionales a gran escala.
Se sabe ya que varios miRNAs actúan como oncogenes (puede contribuir a un tumor) o supresores de tumores. “Este recurso podría optimizar procedimientos analíticos y priorizar microARN para su caracterización funcional y clínica”, afirmaron los investigadores liderados por Piotr Kozlowski, de Polonia.
Cuáles son los desarrollos basados en microARN para cáncer

En la Argentina, investigadores del Conicet y la Universidad Nacional de San Martín (UNSAM) desarrollaron el kit Oncoliq. Según contó la doctora Adriana De Siervi a Infobae, el test permite detectar el cáncer utilizando los microARNs que circulan en la sangre de las personas.
Actualmente están desarrollando el test, que es un tipo de biopsia líquida, para la detección temprana del cáncer de mama, señaló la científica, que es también directora del Laboratorio de Oncología Molecular en el Instituto de Biología y Medicina Experimental (IBYME).
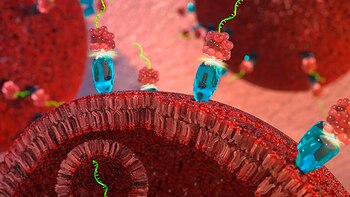
También está en estudio una potencial intervención contra el cáncer, en la Universidad de Purdue, Estados Unidos. Según el estudio publicado en la revista Oncogene, usan un fragmento de microARN-34a modificado que engaña a las células cancerosas para que lo absorban. Al hacerlo, se bloquea la división de las células tumorales.
Por ahora fue probado en ratones. El “microARN actúa como un freno, ralentizando o deteniendo la división celular”, explicó Andrea Kasinski, autora principal del estudio. Además de inhibir el crecimiento tumoral, el microARN-34a suprimió la actividad de al menos tres genes —MET, CD44 y AXL— que están relacionados con la progresión del cáncer y la resistencia a otras terapias.
Últimas Noticias
Órganos de cerdo en humanos: un avance médico que podría transformar los trasplantes
Investigadores avanzan en la edición genética para evitar el rechazo y minimizar los riesgos en xenotrasplantes, un posible cambio de paradigma en la salud.
¿El cerebro se satura con información? Estudios revelan la verdad
Expertos en neurociencia explican cómo la mente filtra datos irrelevantes para mantener su eficiencia sin colapsar

Despegue exitoso, pero pérdida de contacto: así fue el lanzamiento del megacohete Starship de SpaceX
La nave de 122 metros de altura despegó desde el sur de Texas en un nuevo test sin tripulación, pero no logró concretar los objetivos debido a diversas fallas. Los detalles

Un estudio advierte que los microondas esconden bacterias peligrosas y difíciles de eliminar
Investigadores descubrieron que ciertos electrodomésticos pueden convertirse en entornos ideales para microorganismos altamente resistentes

Enigmático hallazgo en una pirámide salvadoreña: figuras de arcilla con cabezas desmontables intrigan a los expertos
Un equipo de arqueólogos encontró en San Isidro cinco figuras con expresiones que varían según el ángulo de observación. Se cree que fueron utilizadas en ceremonias y narraciones simbólicas hace más de dos mil años





