
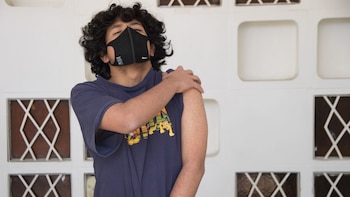
Pese a tener alta disponibilidad de dosis de la vacuna elaborada por Pfizer y BioNTech, la única autorizada de emergencia en el mundo para menores de 12 a 18 años, las autoridades sanitarias del Reino Unido decidieron que sólo inmunizarán en esa franja etaria a quienes tengan enfermedades de base o convivan con un familiar de riesgo.
Es que en opinión del Comité Conjunto de Vacunación e Inmunización (JCVI) que asesora al gobierno de ese país, “los beneficios para la salud en esta población son pequeños y los beneficios para la población en general son muy inciertos”. Los expertos consideraron que “los beneficios para la salud de la vacunación universal en niños y jóvenes menores de 18 años no superan los riesgos potenciales”.
La recomendación se basa en los “informes emergentes del Reino Unido y otros países de eventos adversos raros pero graves, como miocarditis (inflamación del músculo cardiaco) y pericarditis (inflamación de la membrana alrededor del corazón), luego del uso de Pfizer / BioNTech BNT162b2 y vacunas Moderna mRNA1273 en adultos más jóvenes”. Los científicos también consideraron que el riesgo de COVID prolongado era “muy bajo en los niños”, según publicó The Guardian.
Sajid Javid es el secretario de Salud de Boris Johnson y consultado por la prensa británica dijo que aceptaba el consejo de los asesores científicos de que sólo los niños mayores de 12 años con neuro discapacidades graves, síndrome de Down, inmunosupresión y discapacidades de aprendizaje múltiples o graves deberían poder recibir la vacuna Pfizer. “Los niños mayores de 12 años que viven en la misma casa que las personas inmunodeprimidas también serán elegibles para recibir inyecciones”, apuntó el funcionario.
La decisión se tomó en contrario con lo que habían sugerido algunos ministros acerca de que todos los mayores de 12 años podrían comenzar un programa de vacunación a partir de septiembre, lo que contribuirá a la inmunidad de toda la población contra el COVID-19 de cara a la tan ansiada vuelta a la “normalidad”. Sin embargo, el organismo asesor decidió recomendar prudencia a la hora de avanzar en la inmunización de este grupo.

La decisión del gobierno británico dividió a los científicos, muchos de los cuales esperaban que se diera luz verde a la vacuna Pfizer para los mayores de 12 años.
“Parece haber un vínculo con las vacunas y la miocarditis, pero es muy leve y muy raro, pero con Covid, existe el riesgo de una Covid prolongada”, señaló el doctor Stephen Griffin, virólogo de la Universidad de Leeds.
Para Gabriel Scally, profesor visitante de salud pública en la Universidad de Bristol y miembro de Independent Sage, opinó que que la decisión del JCVI “no era lógica”, y señaló que “si bien hay algunos efectos secundarios, son tratables”.
En tanto el profesor de Pediatría Adam Finn, de la Universidad de Bristol y miembro del JCVI, dijo que surgían muchas “pruebas incontrovertibles” de que la inflamación del corazón era una señal de seguridad real, aunque el número de casos graves era “muy, muy pequeño”.
En el ámbito local, si bien esa formulación no está disponible aún en el país, sí lo está la vacuna de Moderna, desarrollada con la misma tecnología de ARNm, que presentó ese efecto adverso en adultos jóvenes vacunados en los países en los que está siendo aplicada. Y que aguarda la inminente autorización de la Administración de Medicamentos y Alimentos (FDA) de los EEUU para su uso en menores de edad.
La Argentina recibió la semana pasada 3.500.000 dosis en lo que fue la mayor donación de vacunas de la administración de Joe Biden a un país de América Latina, y se espera se dé el visto bueno para comenzar a aplicarla en menores con comorbilidades.
En palabras del médico pediatra y presidente de la Sociedad Argentina de Pediatría (SAP) Omar Tabacco (MN 174475), desde la SAP “siempre” van a “estar a favor de las vacunas”. “Por supuesto de aquellas que hayan sido aprobadas por los entes regulatorios (ANMAT en nuestro caso)”, apuntó ante la consulta de Infobae.
Y tras sumar que “hasta ahora la única autorizada a nivel mundial en menores es la de Pfizer”, destacó que “si bien la de Moderna tiene un diseño semejante a Pfizer, aún no fue autorizada por la FDA”.
Para él, “sin dudas debe iniciarse con los adolescentes con morbilidades que los ponen en riesgo de COVID grave, y sin dudas en ellos los beneficios superan ampliamente los riesgos potenciales”.
En consideración del médico infectólogo pediatra Eduardo López (MN 37586), “la vacuna que está autorizada de emergencia a nivel mundial para adolescentes es la de Pfizer”. “Moderna está a la espera de la FDA y Sinopharm y CoronaVac tien aprobación de China para uso de emergencia en menores de edad, pero trabajos publicados sobre seguridad y eficacia sólo se conocen de Pfizer y CoronaVac”, apuntó para dar un cuadro de situación.
“Una vez que se tiene vacuna autorizada, coincido con la recomendación del Reino Unido de primero vacunar a los que tienen factores de riesgo -amplió el jefe del Departamento de Clínica Pediátrica del Hospital Ricardo Gutiérrez-. En niños más pequeños no están completados los estudios: Sinopharm tiene datos de tres a 17 años, y Pfizer y Moderna están terminando sus estudios”.
Y agregó: “Pfizer espera aprobar su vacuna para menores de cinco a 11 años en el otoño boreal, o sea en nuestra primavera, y lo que se sabe es que sería una dosis menor, de 10 microgramos. De las otras autorizadas en adultos en el mundo, de Sptunik V no hay datos en adolescentes, aunque también se realizan estudios, ni tampoco de AstraZeneca; Moderna está haciendo un estudio en 7 mil niños de seis meses a 11 años y espera la autorización de la FDA para 12 a 17. En tanto, mientras de Sinopharm hay menos datos, CoronaVac sí tiene datos de fase I y II en niños y Johnson va a comenzar a estudiar en adolescentes en septiembre”.
“Como puede verse, en la Argentina no tenemos tantas opciones; la más cercana es Moderna y coincido con utilizarla primero en menores con comorbilidades, y en segunda instancia con los que tienen la edad para recibirla aunque no tengan enfermedades de base”, opinó López.
Y tras remarcar que “trabajaría fuertemente en proteger a los adolescentes porque no hay vacunas aprobadas en menores de esa edad”, el especialista agregó el dato de que “los niños debajo de 9 años representan el 3,5% de los casos totales en el país, mientras que en la franja de 10 a 19 la incidencia en el total de los casos está entre el 10 y 12%”.
En general, los casos de esta inflamación cardíaca son aproximadamente uno en 100.000, dijo Jeremy Brown, profesor de infecciones respiratorias en UCL y miembro de JCVI, y advirtió que no había muchos datos en este momento. Sin embargo, dijo, la incidencia de este tipo de efectos secundarios fue más prevalente en los niños que en las niñas, y en el extremo más viejo del espectro adolescente que en los más jóvenes.
SEGUIR LEYENDO
Últimas Noticias
Cómo una pequeña “linterna molecular” podría mejorar la detección de tumores cerebrales y trastornos neurológicos
Todo lo que hay que saber sobre el norovirus: síntomas, contagio y tratamiento

Cuáles son los peligros de la basura espacial que orbita la Tierra y cómo pueden afectar las conexiones a internet y el GPS

El androide olvidado de la NASA: la historia del K6501 que cambió la robótica espacial

Misterio resuelto, descubren las células clave en la formación de glóbulos rojos





